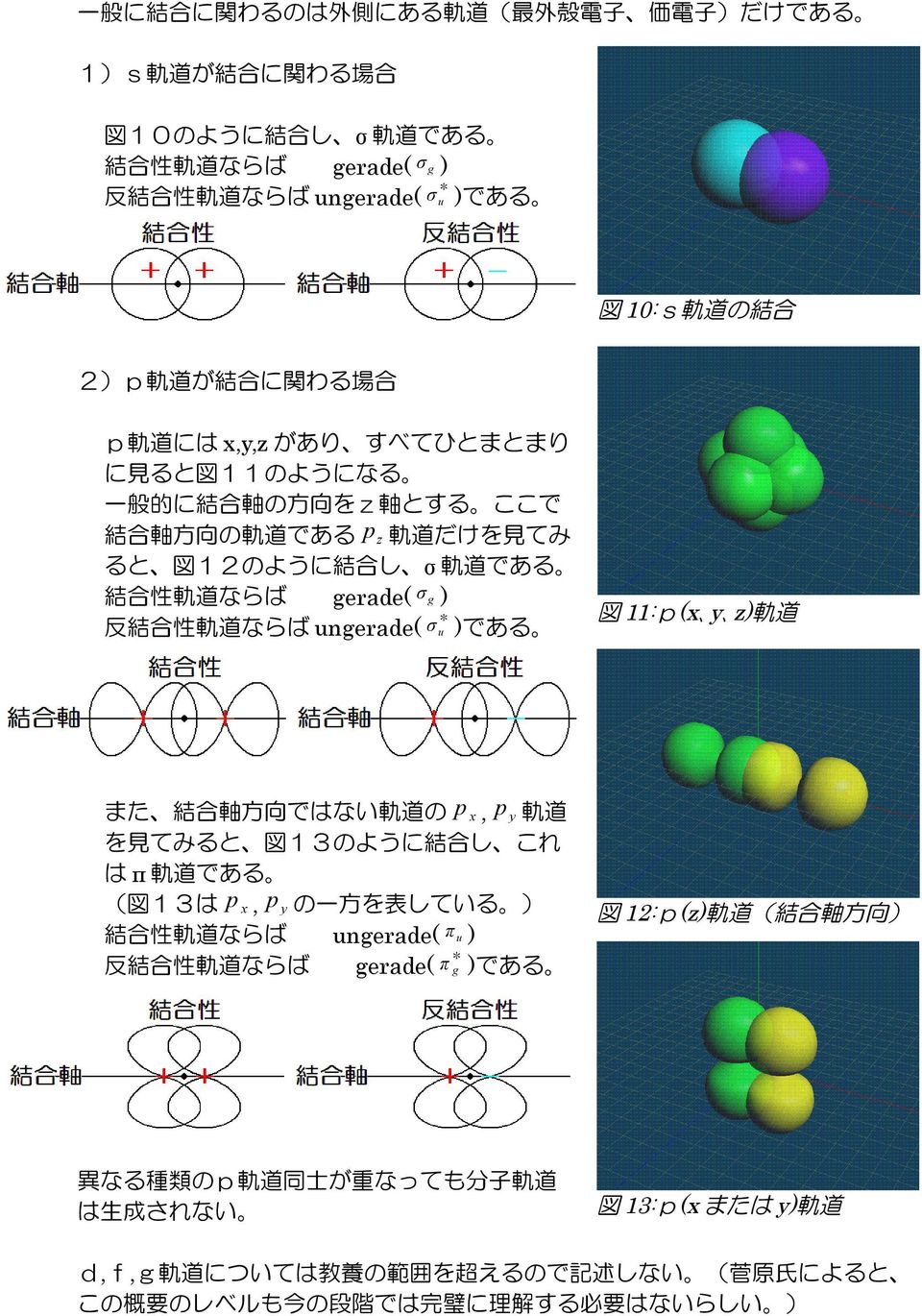
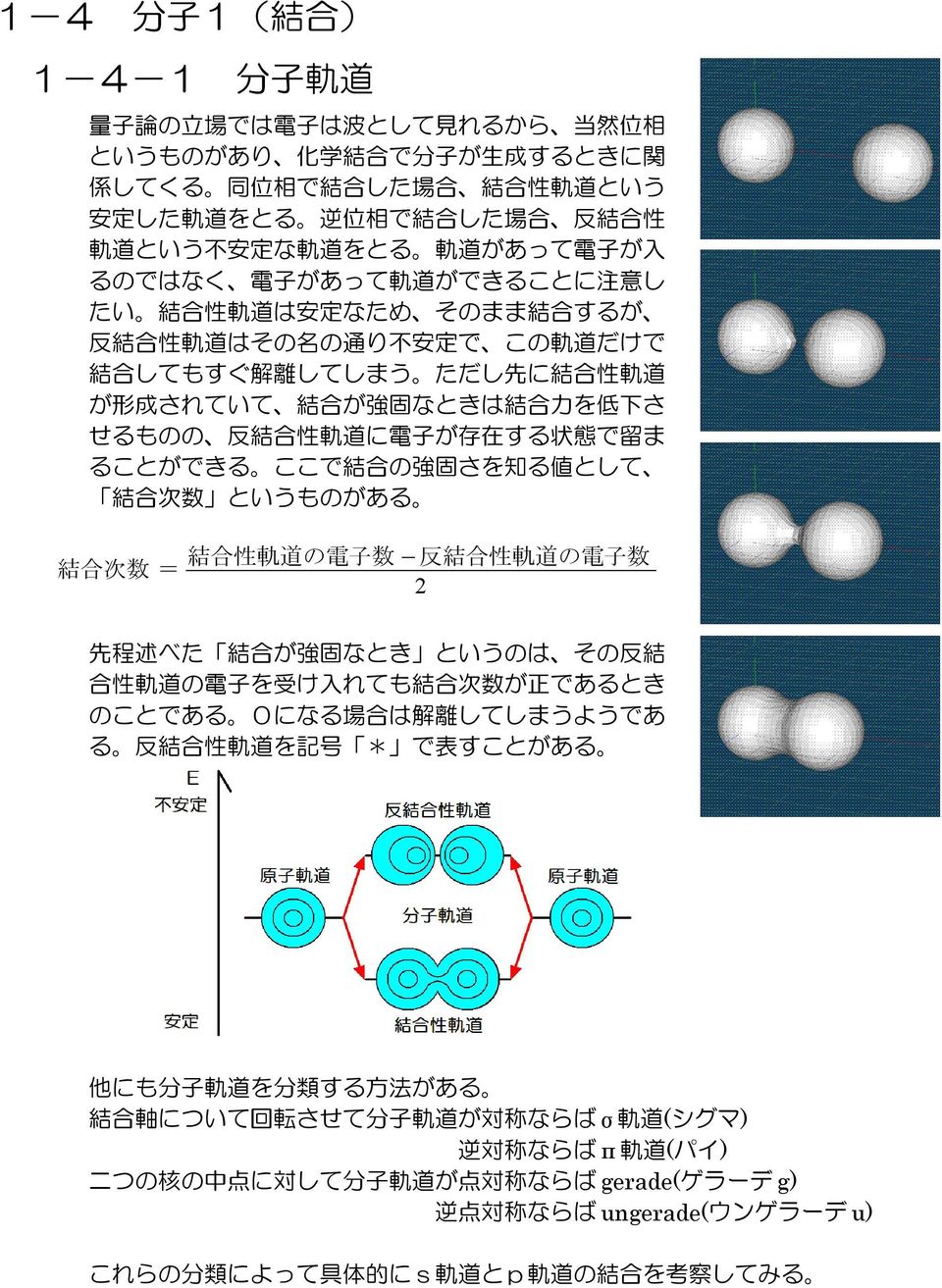
ブタジエン: E π = 2 e 1 2 e 2 = 2(a 162 b) 2(a 062 b) = 4 a 448 b より、 E π ( ブタジエン ) - 2 E π ( エチレン ) = –048 b :非局在化による安定化 1 プロペン (CH 2 =CH–C • H 2 ) の π分子軌道M ) * 9 % "&'!混成軌道 sp3混成 1本のs軌道と3本のp軌道から 結合を形成 正四面体,結合角109° & ' $ % & #"!
構造化学 ベンゼン 創薬メモ
分子軌道エネルギー準位図 ブタジエン
分子軌道エネルギー準位図 ブタジエン-ブタジエンのπ分子軌道 E H 反結合性 H H H 反結合性 H H H H 分子軌道 H H H H H H H H H H 結合性 分軌道 H H H H 分子軌道 H H 練習問題(2Z,4Z)2,4hexadiene∫ 12d < ∫ 2 2d < ∫ m 2d < 1 m 2;




Wo16 号 有機エレクトロルミネッセンス素子 表示装置 照明装置 蛍光発光性化合物及び発光性薄膜 Astamuse
例 表31 点群とそれに属する分子 点群の名称 群 元 素 この群に属する分子 h 2o, so 2, シスブタジエン 1,2ジクロロエチレン(シ ス) nh3, pcl3, ch3cl co, hcl トランス‐ブタジエン 1,2ジクロロエチレン(トランス) ナフタレン, アントラセン, ピレン, ピセン ベンゼン,ン, トランスー1, 4ポ リブタジエン, アイソタクチック1, 2ポ リブタジエンおよびシンジオタクチック1, 2ポ リブタジエンのような分子構造が立体的に規則正しく配 列された新しいポリブタジエンが製造できるようになっ た5.分子軌道法への応用 まず通常の量子力学における分子軌道法に従い、シクロブタジエン分子の分子軌道を導 出してみよう。まず分子全体の波動関数を個々の原子の波動関数の線形結合にて、 ψ=cc1ϕ1 22ϕc3ϕ3c44ϕ と表現する。 (,) (,) (,) ϕ ϕ''δ ϕϕα ϕϕ kk
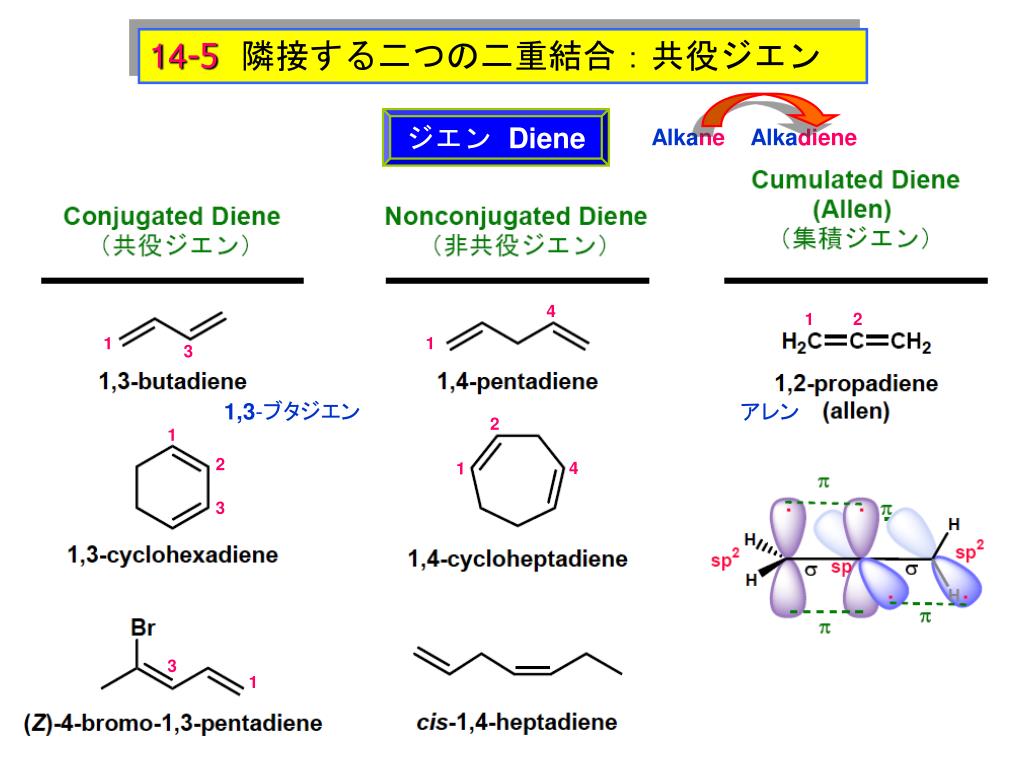
トランス・ブタジエンの分子構造 2pz 原子軌道による π 分子軌道 (07) この方程式は x ≡ (e_o e)/(h es) と置くことで 次の非常に簡単な方程式となる。 (08) この対称行列の固有値 x から分子軌道のエネルギー e が求まる。 (09)分子の面に垂直な軌道となっている。π電子の結合 はσ結合に比べ弱くエネルギー準位が深くないために隣の原子へ自由に飛び移る。 ヒュッケル法(Huc kel method) 分子の波動関数を = c1ϕ1 c2ϕ2 c3ϕ3 c4ϕ4 (1) 異なるπ軌道の重なり積分を0とする。(ϕk;ϕ ′ k) = kK′,16 共役π 電子系~単純 Hückel 法~ 分子軌道法の簡単かつきわめて有用な応用に,共役 電子系に対する Hückel 法がある。 共役 電子系とは,一重結合と二重結合が交互に現れるような系である。 (副読本 pp 142~162)
Mar 11, 16 · さて、線形代数学(C)の講義の固有値問題の話で述べたように、ブタジエンの場合はヒュッケル分子軌道法で4つの固有値=eigen valueが求まります。 このeigen valueと言うことばはもともと量子力学でディラックさんがつくったことばだそうです。 その意味では数学もその応用分野の要請で発展していることがわかります。 さて、このブタジエンの4つの軌道のMay 24, 05 · ブタジエンの分子軌道の具体的な計算の仕方を、なるべく詳細に教えていただけないでしょうか?全てのc原子が直線で並んでいると考えた場合(ヒュッケル近似と言うのでしょうか?)でお願いします。分子軌道論の専門家じゃないけど一応化学ブタジエン分子の基底状態 分子軌道の模式図 最低励起エネルギーはψ 3 ←ψ 2 の電子遷移によるから ∆ E = α– 0618β– α– 0618β= – 1236β




1 概要 基礎編1 1 宇宙の歴史 1 1 1 ビックバン後続過程 1 1 2 質量欠損 1 2 原子1 量子論 1 2 1 量子論への道のり 1 2 2 波動関数 1 3 原子2 電子 1 3 1




Woa1 Material For Organic Electroluminescent Elements And Organic Electroluminescent Element Using Same Google Patents
高エネルギー状態の分子も電磁波に よって低エネルギー状態への遷移が誘 発され,振動数νの光子を発生すること。 吸収の場合と同じ振動数の電磁波だけ が励起状態を刺激し,低エネルギー状 態に落とすことができる。 Smulated Emission LASER"エテンと1,3–ブタジエンの分子軌道は図314と図52を参照すること. ほとんどのDiels–Alder 反応のジエノフィルは少なくとも一つ電子求引基をもって いる(例:反応244).電子求引基はジエノフィルの LUMOのエネルギーを下げるのシクロブタジエン C4H4 上の図のように分子軸を取り番号付けをする。 永年行列式は次のようになる。 x 1 0 1 1 x 1 0 0 1 x 1 1 0 1 x = 0 永年方程式は x (x 3 – 2x) – x 2 – x 2 = x 2 (x 2 – 4 ) = 0 より x = 0, ±2 を得る。 エネルギーの低い順に分子軌道を求めよう。 x = – 2, E= α 2β の場合 – 2 c 1 c 2 c



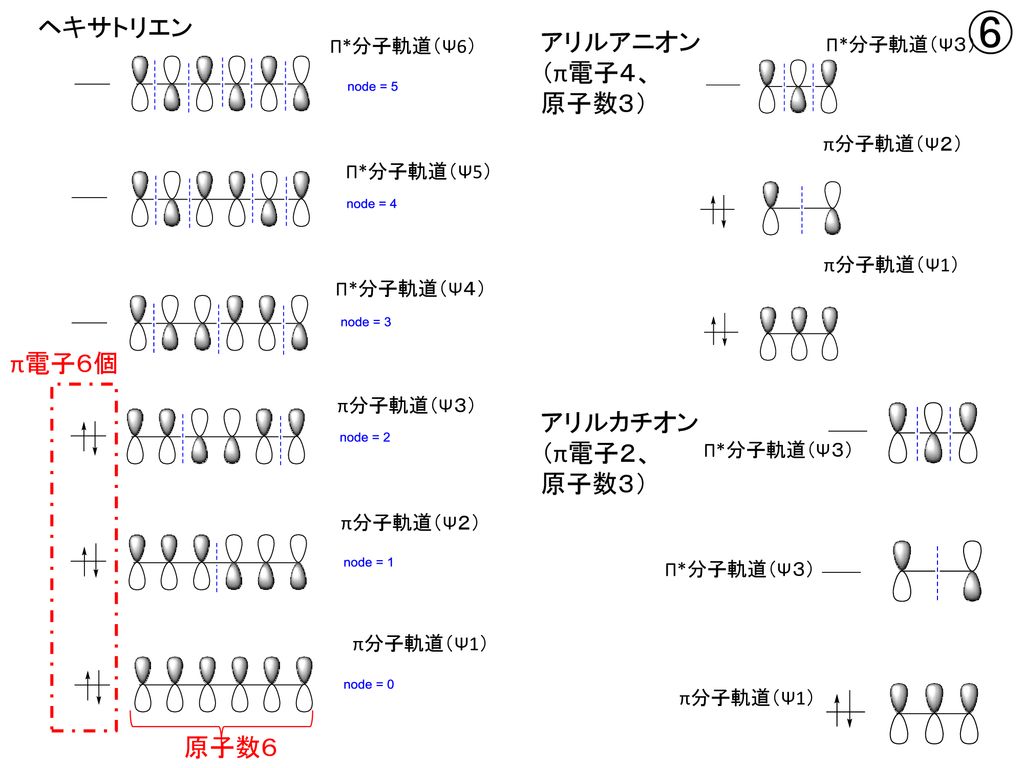
1 3 5 ヘキサトリエン




構造化学 ベンゼン 創薬メモ
& & $ % ' #"!) " &( * ) ,&#$& *%9 ( & /58 ∫ 1H 1d ∫ 2H 2d ∫ mH md 2pディールス・アルダー・スーパージエンを使ってベンゼンをC 2 H 2 とC 4 H 4 に分解する A Diels–Alder super diene breaking benzene into C 2 H 2 and C 4 H 4 units 14年1月8日 Nature Communications 5 3018 doi /ncomms4018



分子軌道理論 Molecular Orbital Theory Mo理論 Ppt Download




ヒュッケル法 前編 手計算で分子軌道を求めてみた Chem Station ケムステ
分子軌道に入り、分子軌道を作った結果として、全部を合わせると、2 5b安定 化していることが解る。 ブタジエンを「2 つのエチレンが合体したものと考え次図にブタジエンの分子図を示した。 図中の結合には全結合次数を示した。3で計算したˇ 電子密度はすべての炭素原子で(t) 同じor 異なる値を 示したが,ˇ結合次数は結合によって異なる。ただし, 分子の対称性からp12 とp34 は(u) 同じor 異なる値と なる。Jun 23, 14 · エタン CーC 全てsp3 ブタジエン C=CーC=C 炭素は全てsp2 二酸化炭素 O=C=O 酸素はsp2、炭素はsp 考え方としてはその元素の結合の腕の数 (炭素なら4本、酸素は2本みたいな)と同じ数の原子がその原子についてたらsp3 つまりエタンみたいに全部単結合の場合です。



プロセス合理化 反応時間の短縮



放浪者の道標 基礎有機化学 アリル型カルボカチオンの共鳴
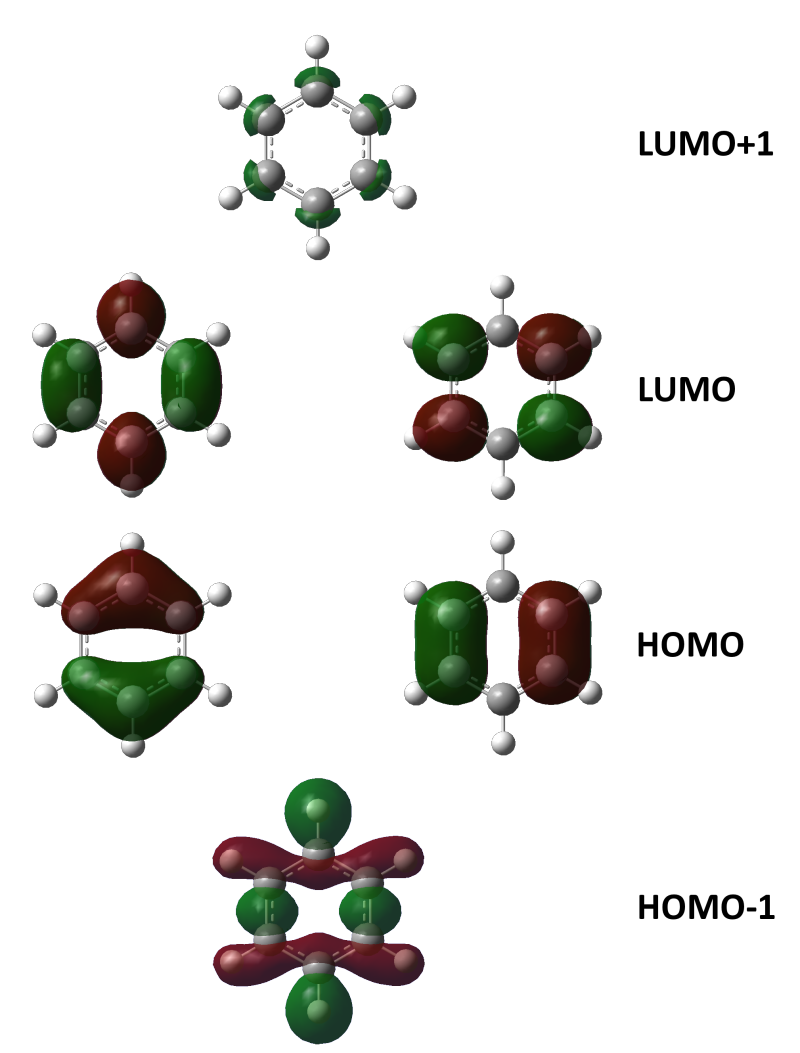
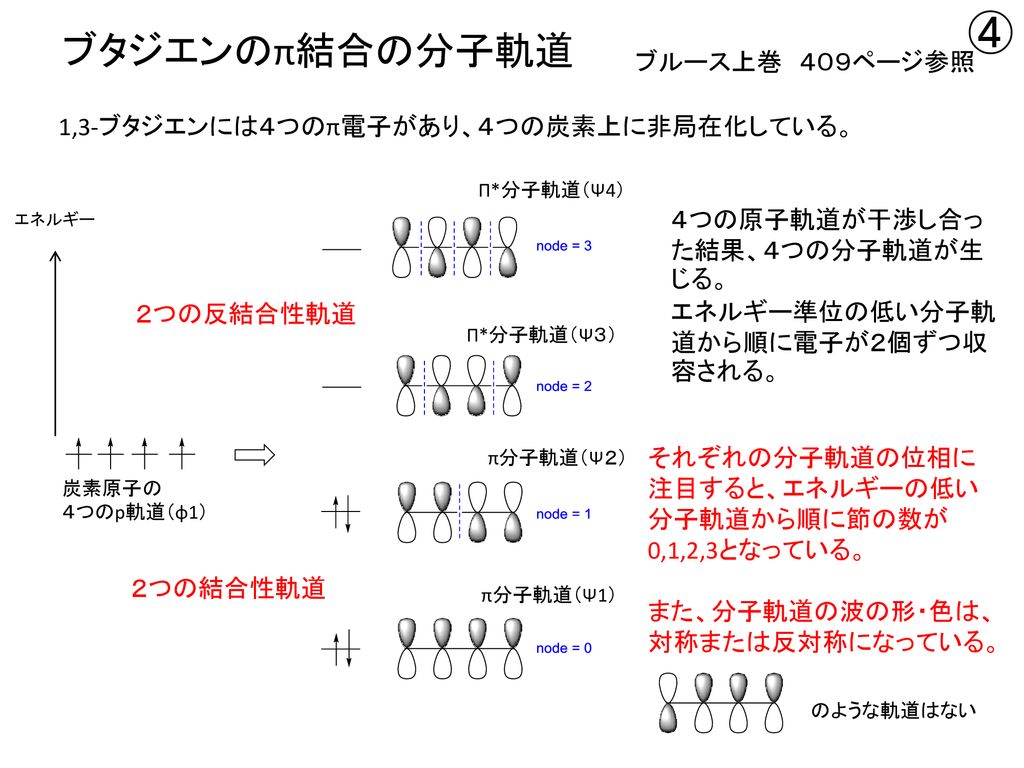
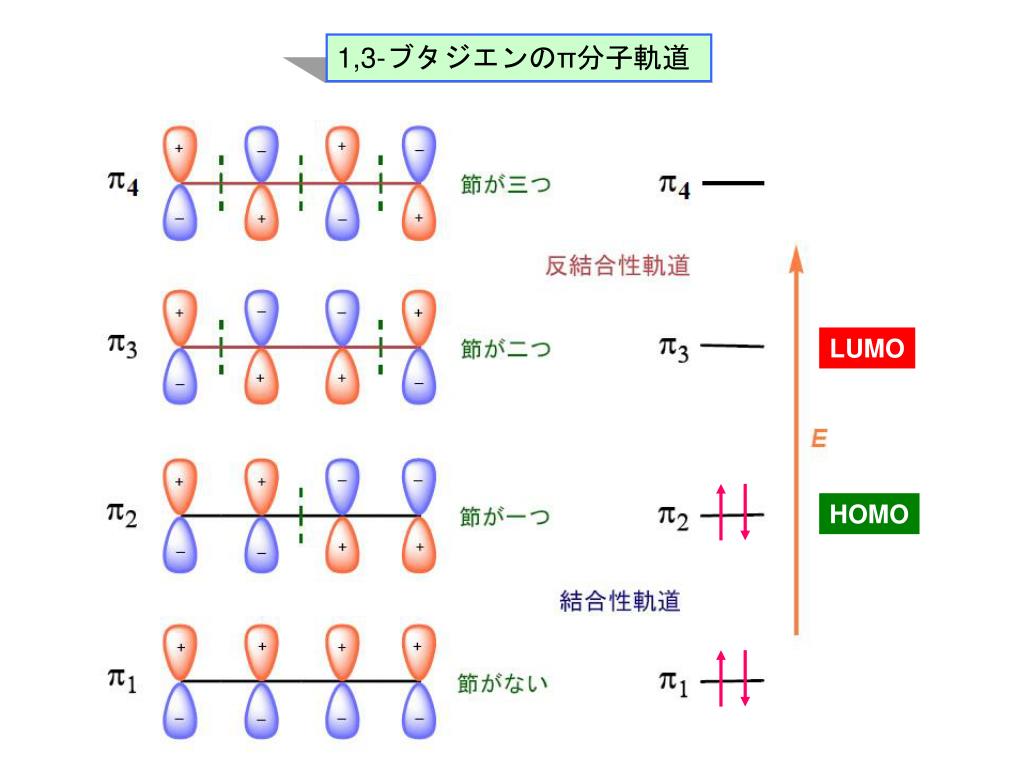
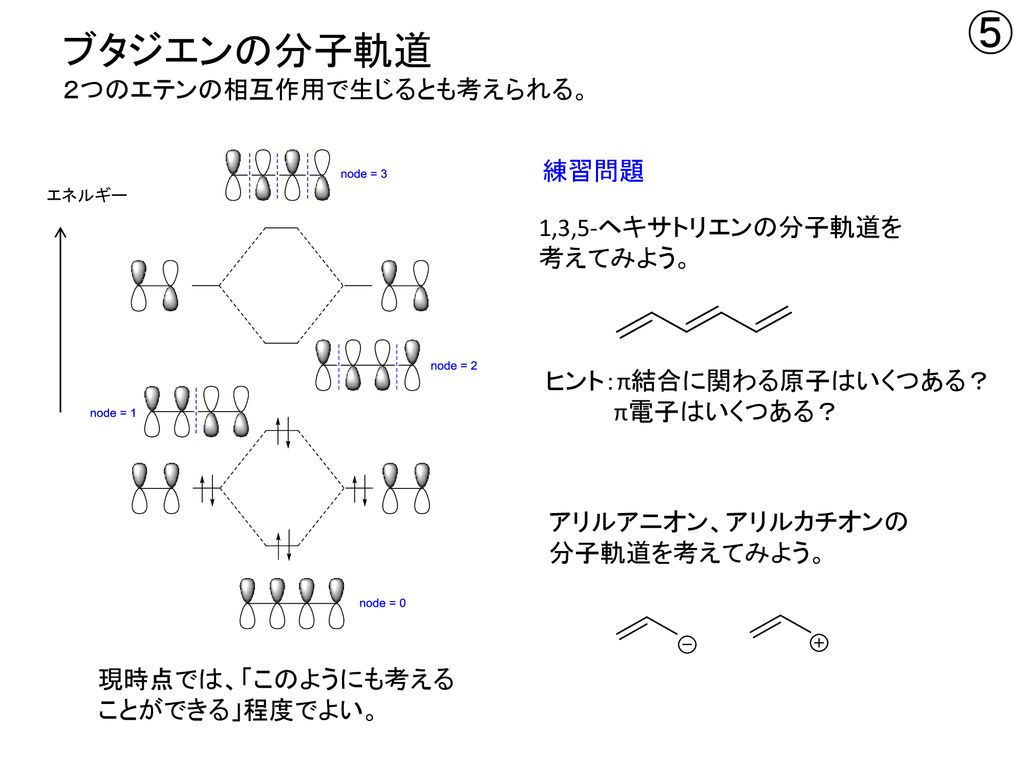
ブタジエンは、共役二重結合を持つ最も単純な分子である。 1,3ブタジエンのπ分子軌道についても、C1~C4の2p z軌道がすべて相互作用して、 新しい分子軌道を4つ作ると考える。分子軌道の形とエネルギーは、下の図のようにな あることがわかっている。アリルカチオンのπ分子軌道 C C C H H H H H 2 allyl cation 1 2 3 C3 2pz C2 2pz C1 2pz (最もエネルギー低い) (最もエネルギー高い) 非局在化に関与する3個の p 軌道が相互作用して 新しい分子軌道を3つ作る 4子軌道は結合性分子軌道,逆 の場合は反結合性分子軌道 となる。ブタジエンのψ1,ψ2は結合性分子軌道であ り,ψ3,ψ4は反結合性分子軌道である。 一般にn個 の炭素原子からなる共役ポリエンでは, n個 の分子軌道関数ができ,エ ネルギーの低い方から順 にψ1,ψ2



ヨウ素とは ヨウ素学会




反結合性軌道 Wikipedia
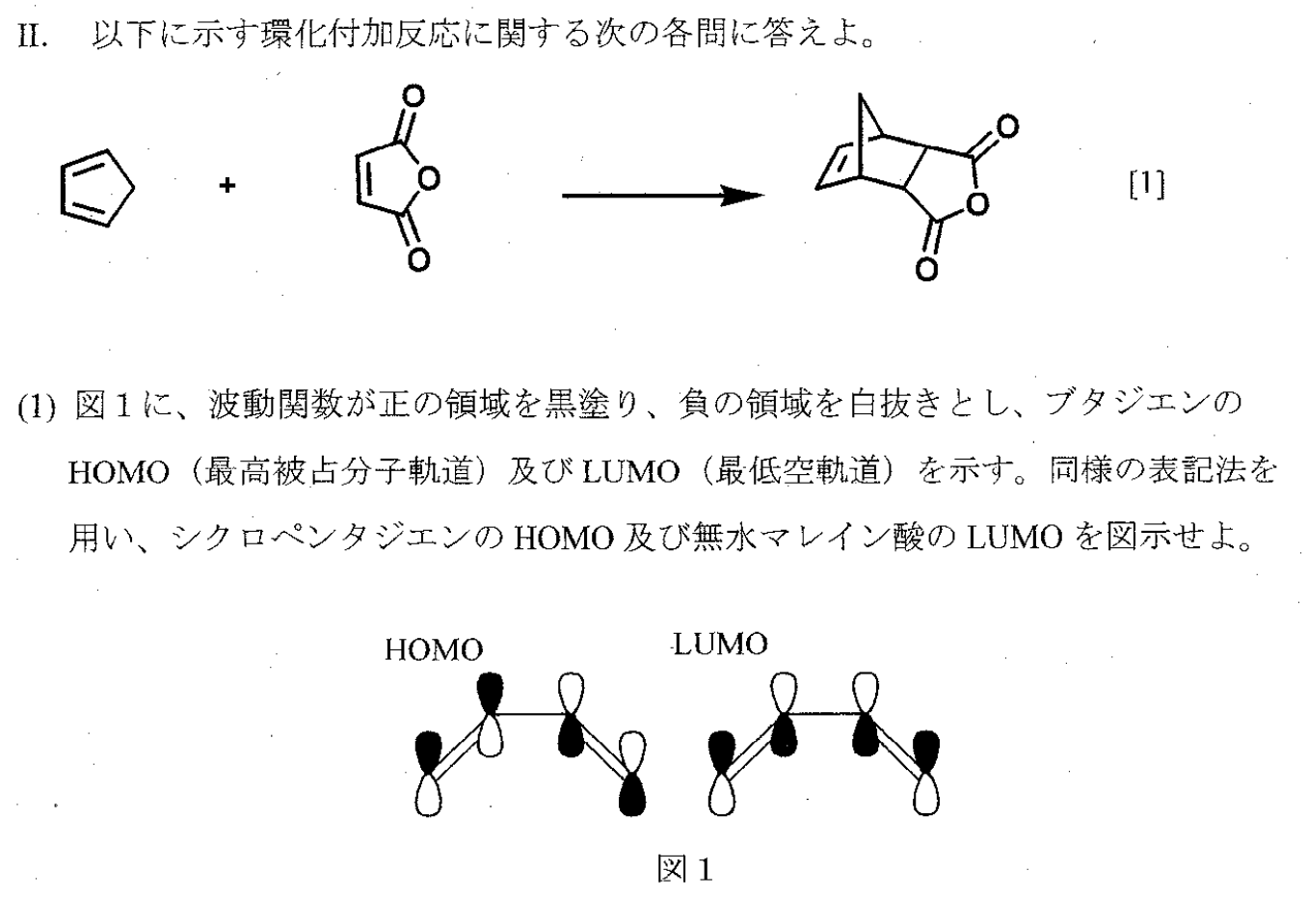
一方、エチレンの軌道は e = d e e = d – e であるからエチレン1 分子の全エネルギーは2d 2e である。よってシクロブタジエンの全エネ ルギーはエチレン1 分子の全エネルギーのちょうど2 倍であるから、シクロブタジエンと2 つのを水平線に垂直に描き、各軌道の符号を黒と白を使って示せ。 さらに、節点を黒丸で示せ。なお、各2pz 軌道の分子軌道への 寄与の差は考慮する必要は無い。 図2:エチレンのπ分 子軌道。黒丸は節点を 示す。 図1:1,3ブタジエンの構造 と各炭素の番号Eπ(ブタジエン)-2×eπ(エチレン)=4α4β2(2α2β) =0 つまり,シクロブタジエンでは非局在化安定化エネルギーはゼロである. 占有数 分子軌道係数 計算出力例 lcaomoの係数(分子軌道係数)を求めるには,永年行列式を解いて



分子軌道理論 Molecular Orbital Theory Mo理論 Ppt Download




ヒュッケル法 前編 手計算で分子軌道を求めてみた Chem Station ケムステ
Eπ(ブタジエン)-2×eπ(エチレン)=4α4β2(2α2β) =0 つまり,シクロブタジエンでは非局在化安定化エネルギーはゼロである. 占有数群論と結晶場 6 / 28 佐藤研究室 6 既約表現の記号 Mulliken の記号 1 一次元既約表現は、A or B で表す 主軸の回転に対して対称の場合A(指標が1) 主軸の回転に対して反対称の場合B(指標がー1) 主軸に垂直なC2 軸(D 対称)や主軸に平行なσ面をもつとき、 対称=下付数字1ブタジエンの分子軌道を (ギリシア文字でphi)とすると, は4 個の炭素原子の2p 原子軌道 (chi)の1 次結合で表すことができる。, , , は分子軌道の係数である。1, 3 ブタジエンの場合,軌道は4 軌道あり, 電子の 19 1Huckel 分子軌道法 城西大学理学部化学科




雑誌会回答 伊藤



Ppt 14 章 非局在化した P 電子系 Powerpoint Presentation Id
は分子軌道を形成する際に対称性が異なるため混じ り合わない。よって,分子のˇ 電子系を考える場 合には,ˇao だけを取り出して,これの線形結合 で分子軌道を作ってよい。これを (d) 近 似という。この近似により組み立てられるmo を1,3ブタジエン (4π電子) エテン (2π電子) シクロヘキセン (環化付加物) DielsAlder反応は42環化付加反応である! 4つのπ電子を持つ共役した4つの原子の集団が, 2つのπ電子を持つ二重結合と反応する.実行例1 ブタジエン C1=C2C3=C4 **** ヒュッケル分子軌道法計算のプログラム **** 化合物名 Butadiene 原子数 4 結合数 3 π電子数 4 ヘテロ・パラメータ数 0 結合している原子の組を ,で区切って入力してください 1 1, 2



講義 有機化学1 第15回目の講義から 1 分子軌道法について エチレンとブタジエンのp結合について 片桐教授 東京工科大学 工学部 応用化学科 ブログ



分子軌道理論 Molecular Orbital Theory Mo理論 Ppt Download
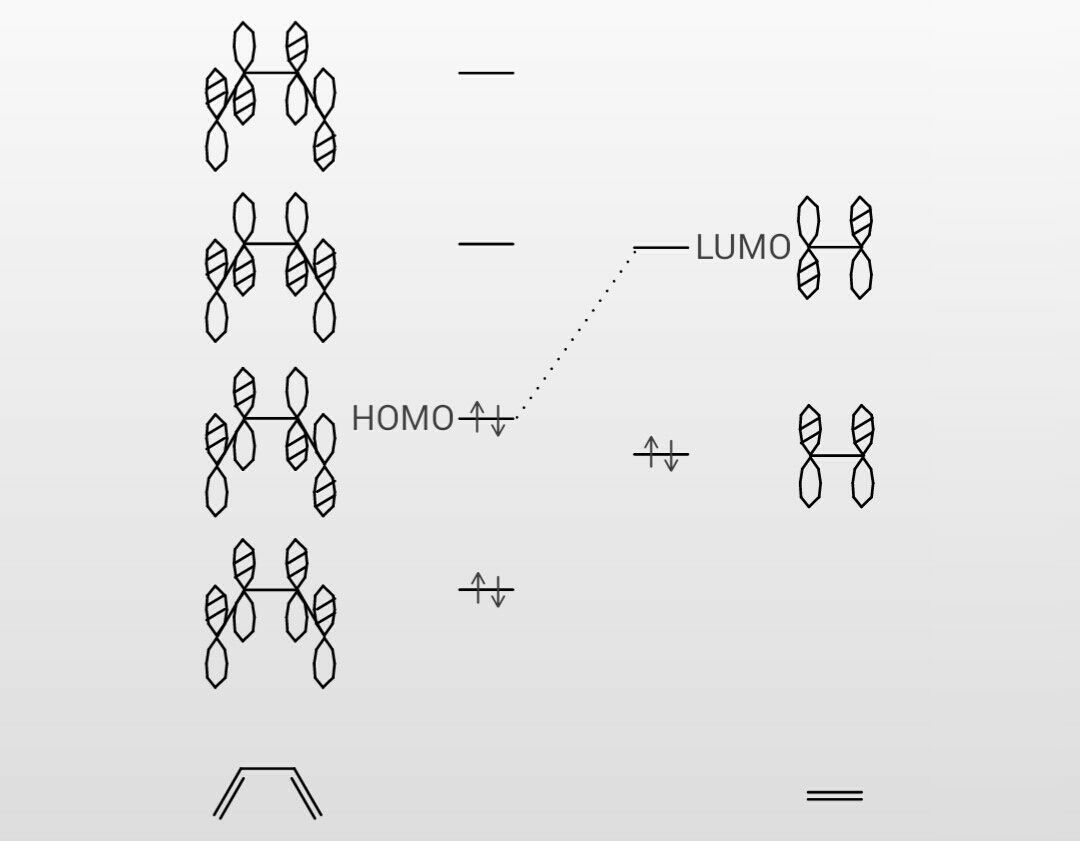
ヒュッケル法(ヒュッケルほう、英 Hückel method )は、ドイツのエーリヒ・ヒュッケルによって提案された分子軌道法である。 エチレンや1,3ブタジエン、ベンゼン等のπ電子 共役分子に適用する例が入門用としてよく用いられる。 ヒュッケル法では電子に関する積分に対して以下のような近似Jul 07, 08 · 水素類似原子の原子軌道 ポリエン 芳香族炭化水素 シクロブタジエン シクロデカペンタエン ホルムアルデヒド ジエンとジエノフィル アンビデントアニオン シクロプロピルメチルカチオン メチルハライドJan 12, 12 · 電子が入っていない(空の)最もエネルギーが低い軌道はπ*軌道になります。 つまり、エチレンの場合は、HOMO=π軌道、LUMO=π*軌道となります。 エチレンの HOMOとLUMOはこのように簡単に求めることができます。 しかし、π電子の数が増えていくとπ軌道の数




分子軌道 Wikipedia



分子軌道理論 Molecular Orbital Theory Mo理論 Ppt Download
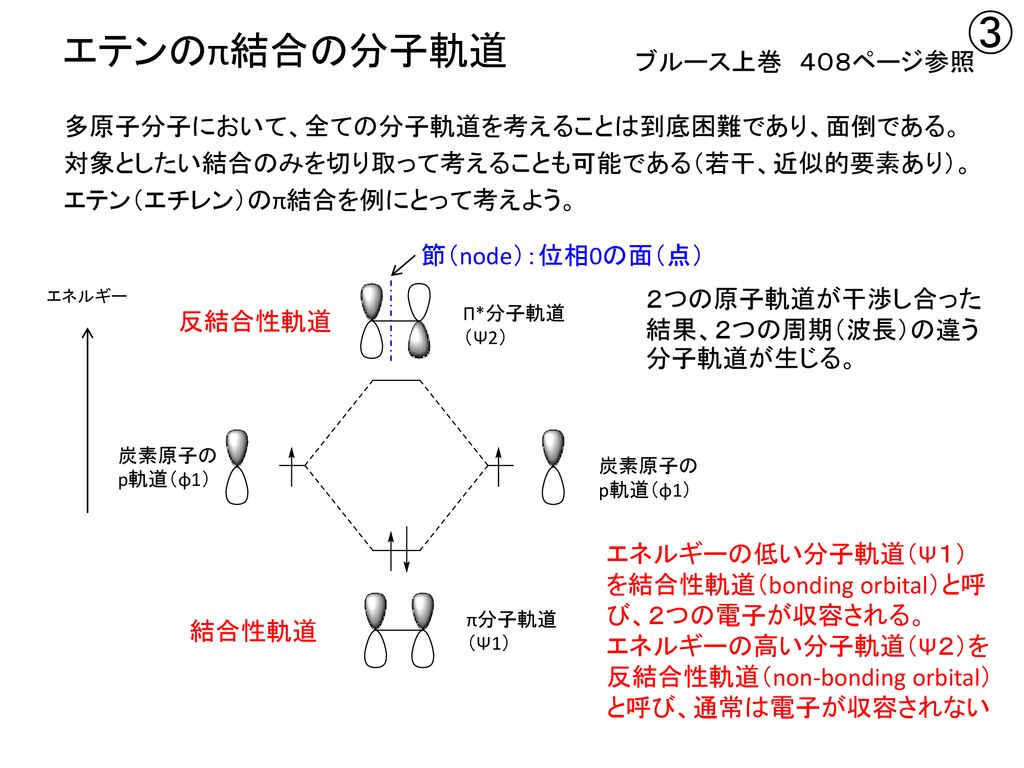
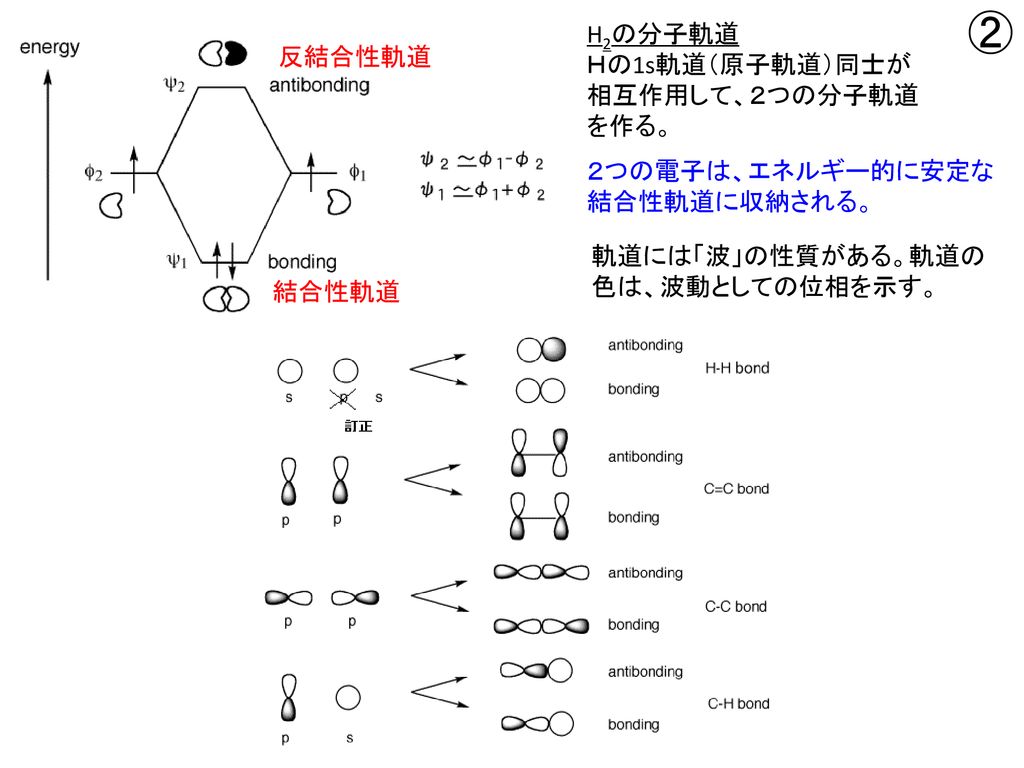
1 共役系の分子軌道 1 エチレンの分子軌道-p 電子近似 エチレン分子は、322~4 で述べたように、炭素原子軌道が sp2 混成をしてお り、図 1 に示すように、平面内にあるs H H 分子軌道と、面外に突き出たp分子軌道 s分子軌道 C C H が形成される。つまり電子が存在している軌道のうち、最もエネルギーが高い軌道のことを指す。1,3ブタジエンの軌道を示している下の図で青色で囲んでいる軌道がHOMOとなっている。 それに対し、LUMOは「Lowest Unoccupied Molecular Orbital」のことであり、最低空軌道と訳される。LUMOは電子がない空の軌道のうち、最もエネルギーの低い軌道のことを指す。は、窒素、酸素)からなる平面分子においては、面外に広がる2p軌道(p 軌道)だけを扱う。 kはk 番目のp 原子軌道である。Mは考慮する kの数。c pi はi番目の分子軌道のp番目のp 原子軌道の 係数である。



H26 有機化学




Wo16 号 有機エレクトロルミネッセンス素子 表示装置 照明装置 蛍光発光性化合物及び発光性薄膜 Astamuse
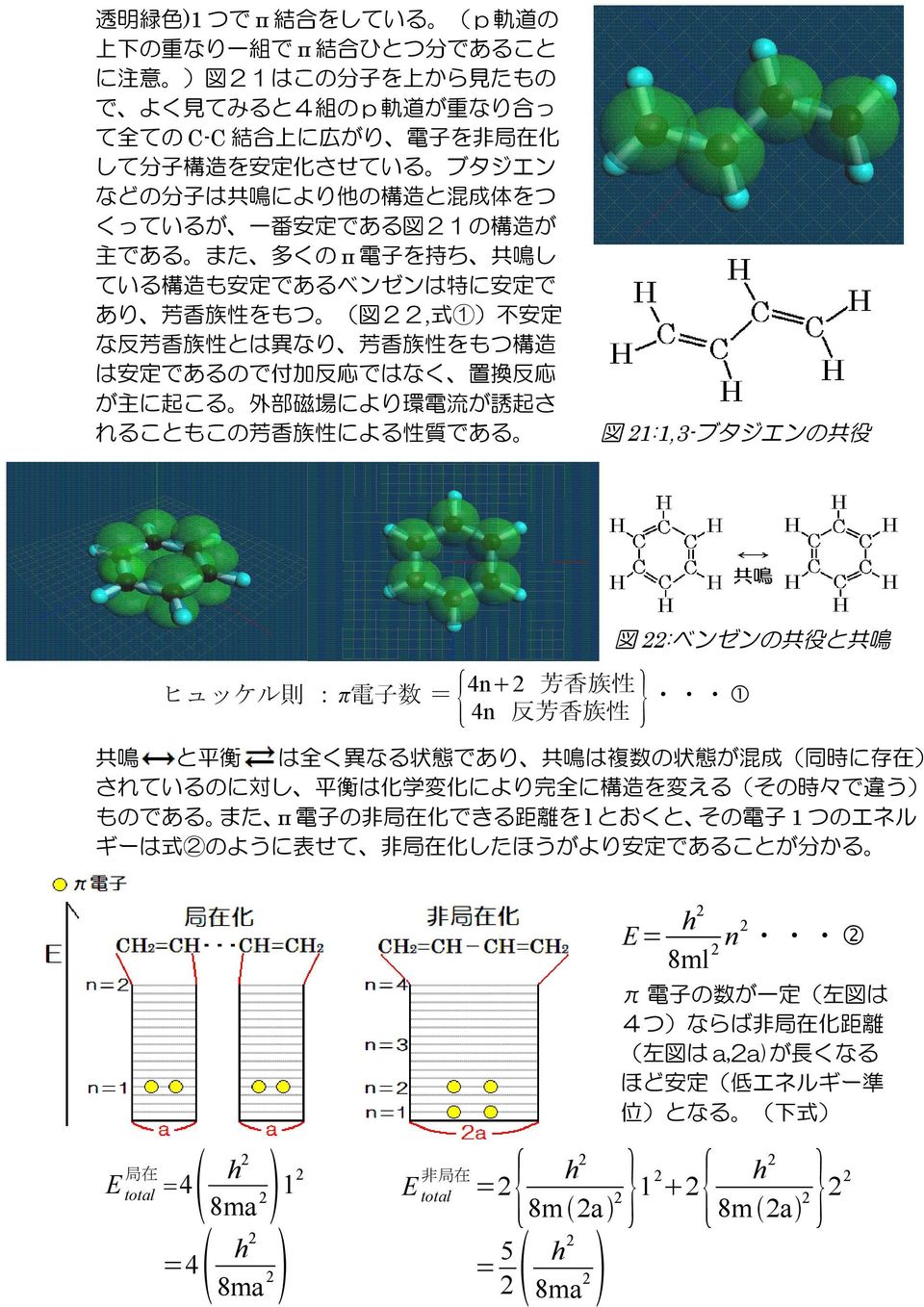
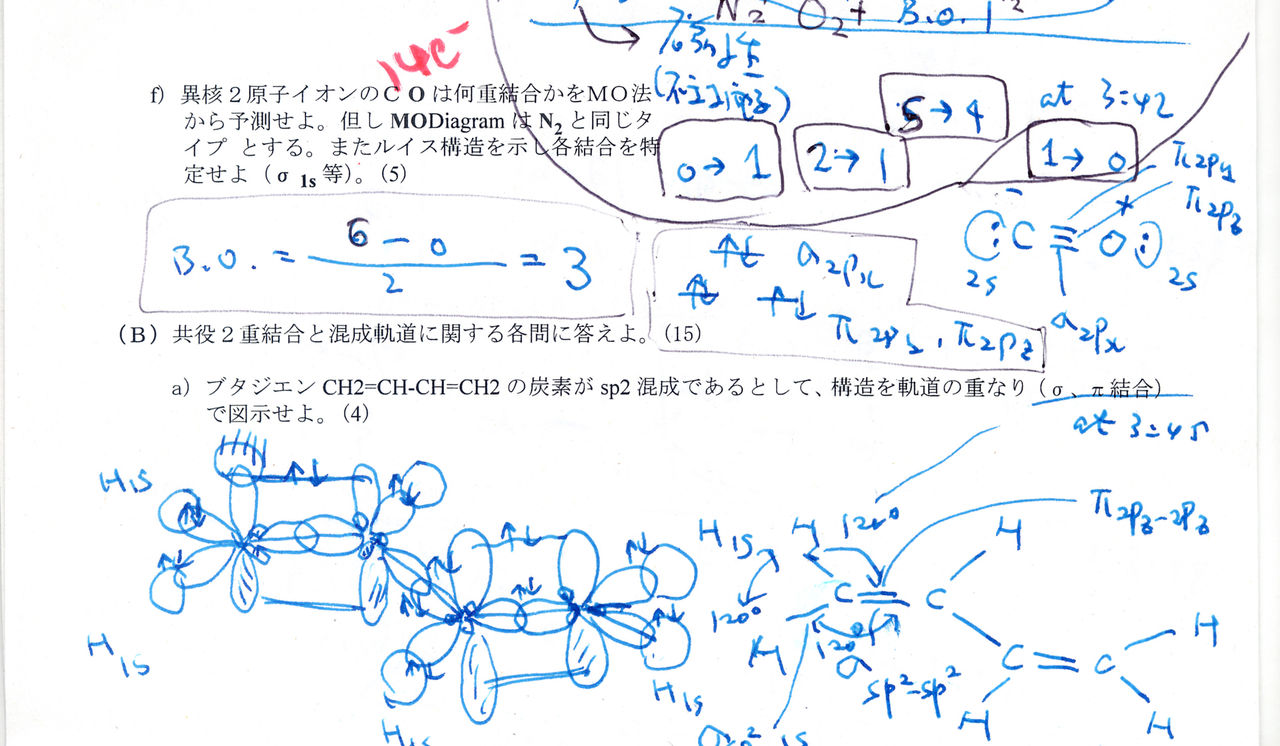
ブタジエン( CH2=CHCH=CH2 ) 本来,電子の運動は,分子全体に広がっている.エネルギーを詳しく議論するには,分子軌道で議論しなければならないが,分子の形や大まかな性質を考える場合には,混成軌道の考えかたのほうが簡単である. 次の例は,分子の骨格を混成軌道法でくみたて,物質の性質を分子軌道法であつかっている. 図 r92 ブタジエン.ブタジエンを



1 概要 基礎編1 1 宇宙の歴史 1 1 1 ビックバン後続過程 1 1 2 質量欠損 1 2 原子1 量子論 1 2 1 量子論への道のり 1 2 2 波動関数 1 3 原子2 電子 1 3 1



1 概要 基礎編1 1 宇宙の歴史 1 1 1 ビックバン後続過程 1 1 2 質量欠損 1 2 原子1 量子論 1 2 1 量子論への道のり 1 2 2 波動関数 1 3 原子2 電子 1 3 1




有機分子ワイヤを通る電子移動速度の高速化を実現 電子移動研究 分子デバイスの新たなマイルストーン プレスリリース 東京大学 大学院理学系研究科 理学部



分子軌道理論 Molecular Orbital Theory Mo理論 Ppt Download




Muvejc2oxox Zm




A Low Spin Fe Iii Complex With 100 Ps Ligand To Metal Charge Transfer Photoluminescence




有機分子の分子軌道計算と活用 分子軌道法を用いた有機分子の性質と基本的反応の計算と活用 染川 賢一 本 通販 Amazon



単純ヒュッケル法による分子軌道の計算と共鳴安定化



1 概要 基礎編1 1 宇宙の歴史 1 1 1 ビックバン後続過程 1 1 2 質量欠損 1 2 原子1 量子論 1 2 1 量子論への道のり 1 2 2 波動関数 1 3 原子2 電子 1 3 1




分子軌道理論 Molecular Orbital Theory Mo理論 Ppt Download




大学有機化学 単離可能なシクロブタジエン 反芳香族性分子の驚き構造と反応性 Youtube



単純ヒュッケル法による分子軌道の計算と共鳴安定化




ヒュッケル法 前編 手計算で分子軌道を求めてみた Chem Station ケムステ




1 概要 基礎編1 1 宇宙の歴史 1 1 1 ビックバン後続過程 1 1 2 質量欠損 1 2 原子1 量子論 1 2 1 量子論への道のり 1 2 2 波動関数 1 3 原子2 電子 1 3 1



ディールスアルダー反応 この世を科学的に知ろう



12まとめ Blogchemistry



単純ヒュッケル法による分子軌道の計算と共鳴安定化
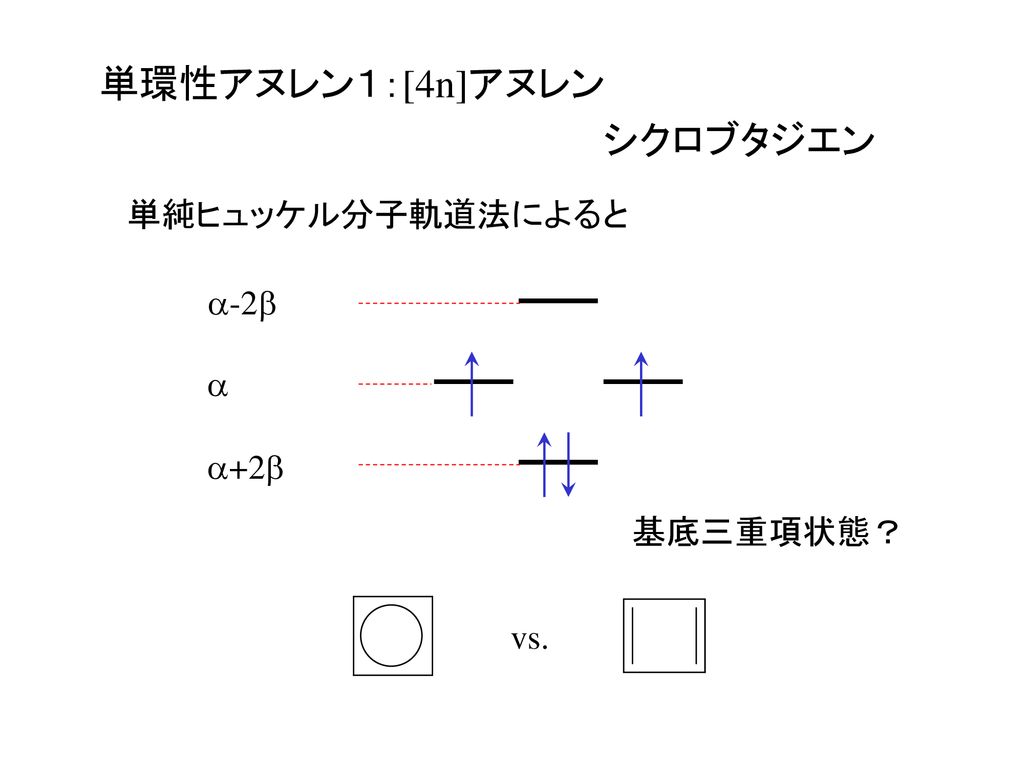



平成18年度 構造有機化学 講義スライド テーマ 芳香族性 奥野 恒久 Ppt Download




ヒュッケル法 前編 手計算で分子軌道を求めてみた Chem Station ケムステ



14 炭化水素分子内の炭素ー炭素結合と電子 炭素の科学




Woa1 Organic Light Emitting Device Google Patents



単純ヒュッケル法による分子軌道の計算と共鳴安定化
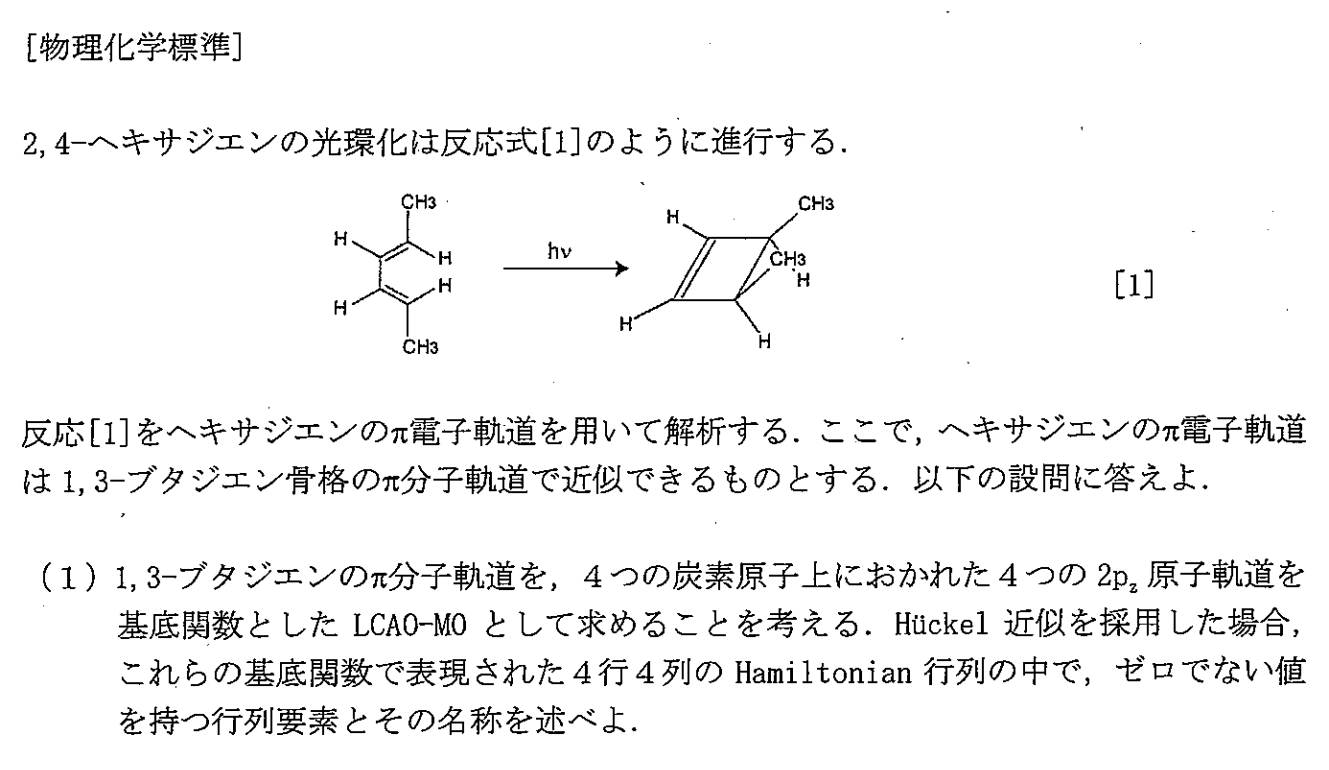



H21 物理化学標準




水の分子軌道について 水の分子軌道の形状についての質問させていただきます Okwave
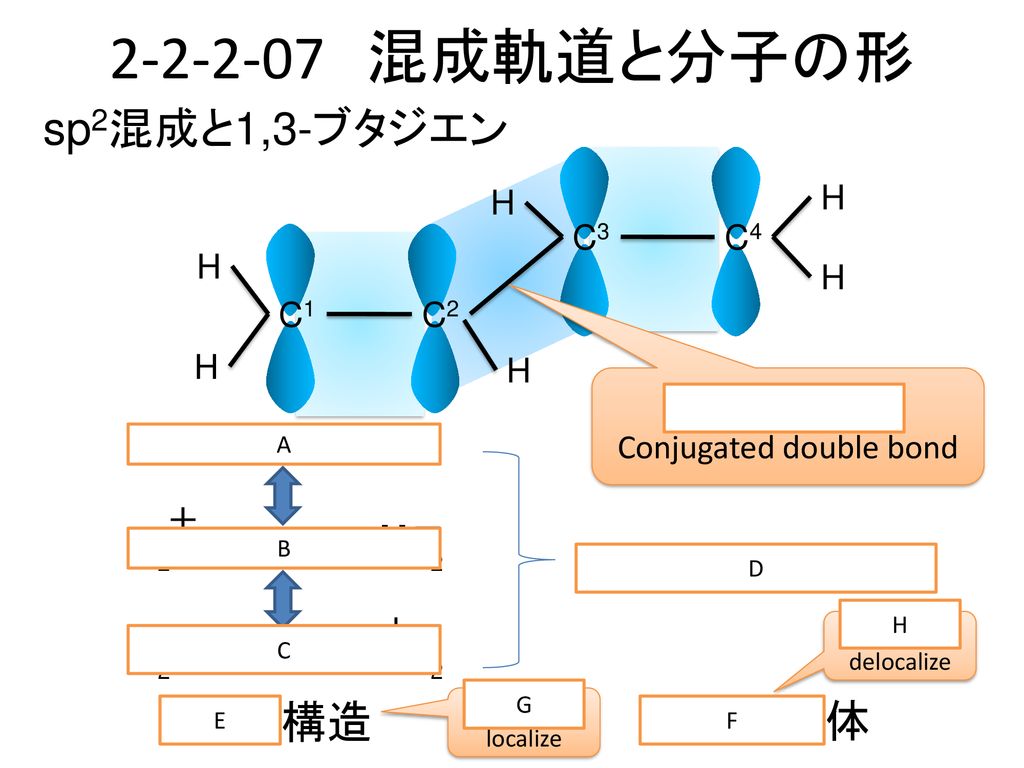



学年 名列 名前 物理化学 第2章 2 1 2 2 Ver 2 1 福井工業大学 原 道寛 Hara Ppt Download




ヒュッケル法 前編 手計算で分子軌道を求めてみた Chem Station ケムステ



No comments:
Post a Comment